添加日期:2017年6月20日 阅读:1786
15年前,美国食品和药物管理局(FDA)在印度没有进行任何的生物利用度或生物一致性检查,如今,FDA近一半的检查是在印度进行。
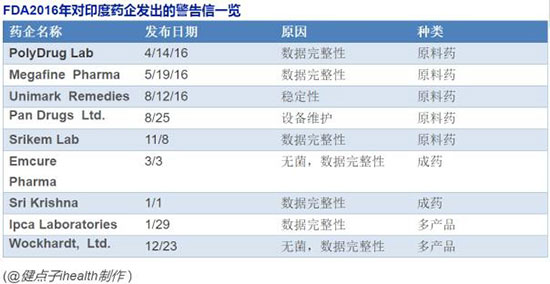
这是因为,由于数量猛增,众多数据质量问题浮现。
数据完整性问题,即:有意或无意操纵研究数据成为这些检查的焦点。
这是三位美国食品药品管理局的官员周一齐聚DIA芝加哥年会上所表示的。
数据完整性的普遍违规虽然可能是由于疏忽或意外引起,但也是由于故意的不当行为,因为研究外包CRO公司经常试图挽救失败的研究,从而吸引赞助方带来更多的后继工作。
“如果你是CRO (合同研究机构)或研究赞助方,并注意到故意的数据操纵(现象),就必须严肃认真对待... 因为FDA可以进行检查,但*终还靠赞助方和CRO的加倍努力。”FDA研究一致性和监督办公室(OSIS)副主任达斯古普(Arindam Dasgupta)表示说。
达斯古普接着解释说,这些不足之处并不是只在印度才有,但由于研究量成倍增长,问题在这里更显突出。
监管合作正当时
与此同时,通过与印度监管部门的合作,FDA和印度中央药物管理组织(CDSCO)和印度药物管理总署经过了两年半的时间的工作,也取得进展。双方增加了互动,有利于监管体系的增强。
尤其是,双方的互动加强了对FDA的信心,即将离任的FDA驻印度办公室主任马修-托马斯(Mattew Thomas)表示。
FDA在印度的检查包括有因的飞行检查。但是,FDA的新德里办公室也向印度政府事先通报一些检查将会发生。
由此可见,FDA与印度政府和药物监管机构的合作日益增加。
生物一致性评价(BE)和生物利用度(BA )研究数量在印度增长,还有其他原因, 这位FDA官员表示。
在2013年,印度政府放宽了其一些更严格的监管要求。政府以前要求公司签署知情同意书进行录像,但是“这似乎并不起作用,现在只对某些脆弱的受试者是有必要的”。
印度政府还采用了一个新的质量检查表,发布了一本新的手册,以便公司更好地了解应用程序以及工作步骤。
FDA的基于风险的检查意味着,下次检查的确定通常要看上次检查的时间,检查的结果,以及纠正的措施和待检查的申请的数量,OSIS办公室主任肖恩喀西姆(Sean Kassim)指出。
文章来源:
1.凡本网注明“来源:1168医药招商网”的所有作品,均为广州金孚互联网科技有限公司-1168医药招商网合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:1168医药招商网http://www.1168.tv”。违反上述声明者,本网将追究其相关法律责任。
2.本网转载并注明自其它来源(非1168医药招商网)的作品,目的在于传递更多信息,并不代表本网赞同其观点或和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。
3.其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
4.如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。联系邮箱:1753418380@qq.com。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。
 粤公网安备 44011102000390号
粤公网安备 44011102000390号