添加日期:2023年11月29日 阅读:918
广大药师注意,一批中药制剂,说明书改了。
01、三款中药制剂,说明书有变
11月22日,国家药监局网站发布《关于修订风寒感冒颗粒、穿心莲注射液药品说明书的公告》和《关于修订二十五味珊瑚制剂药品说明书的公告》。
国家药监局表示,上述药品的上市许可持有人均应当依据《药品注册管理办法》等有关规定,按照相应附件要求修订说明书,于截至日期前报省级药品监督管理部门备案。修订内容涉及药品标签的,应当一并进行修订;说明书及标签其他内容应当与原批准内容一致。在备案之日起生产的药品,不得继续使用原药品说明书。药品上市许可持有人应当在备案后9个月内对已出厂的药品说明书及标签予以更换。
同时,药品上市许可持有人应当对新增不良反应发生机制开展深入研究,采取有效措施做好药品使用和安全性问题的宣传培训,指导医师、药师或患者合理用药。
此外,临床医师、药师应当仔细阅读上述药品说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的获益/风险分析;患者用药前应当仔细阅读药品说明书,使用处方药的,应当严格遵医嘱用药。
风寒感冒颗粒说明书修订要求
一、【警示语】项应当增加:
本品含麻黄,运动员慎用。
二、【禁忌】项应当增加:
对本品及所含成份过敏者禁用。
三、【不良反应】项应当增加:
监测显示,风寒感冒颗粒可见以下不良反应报告:
恶心、呕吐、口干、口苦、腹泻、腹痛、腹部不适;皮疹、瘙痒、荨麻疹、出汗、局部皮肤反应;头晕、嗜睡、失眠、乏力、胸闷、心悸、过敏反应等。
四、【注意事项】项应当增加:
本品含甘草,不宜同时服用海藻、京大戟、红大戟、甘遂、芫花或其制剂。
(注:如原批准说明书的安全性内容较本修订要求内容更全面或更严格的,应保留原批准内容。说明书其他内容如与上述修订要求不一致的,应当一并进行修订。)
穿心莲注射液说明书修订要求
一、【警示语】项应当增加以下内容:
1.本品不良反应包括过敏性休克,应当在有抢救条件的医疗机构使用,使用者应当接受过过敏性休克抢救培训,用药后出现过敏反应或其他严重不良反应须立即停药并及时救治。
2.禁止静脉给药。
二、【不良反应】项应当增加以下内容:
监测数据显示,本品可见以下不良反应:
过敏反应:皮肤潮红、皮疹、瘙痒、呼吸困难、心悸、过敏或过敏样反应、过敏性休克等。
全身:胸部不适、发热等。
皮肤及皮下组织:皮疹、瘙痒、多汗、潮红等。
神经系统:头晕、头痛等。
胃肠系统:恶心、呕吐、腹痛等。
其他:心悸、呼吸困难、注射部位疼痛等。
三、【禁忌】项应当增加以下内容:
1.对本品及所含成份过敏者禁用。
2.本品含苯甲醇,禁止用于儿童肌肉注射。
四、【注意事项】项应当增加以下内容:
1.本品不良反应包括过敏性休克,应当在有抢救条件的医疗机构使用,使用者应当接受过过敏性休克抢救培训,用药后出现过敏反应或其他严重不良反应须立即停药并及时救治。
2.严格按照药品说明书规定的功能主治使用,禁止超功能主治用药。
3.严格按照药品说明书推荐的用法用量使用,禁止静脉给药。
4.用药前应当仔细询问患者情况、用药史和过敏史。有药物过敏史或过敏体质者慎用。
5.本品保存不当可能会影响药品质量,用药前应当认真检查本品,发现药液出现浑浊、沉淀、变色、结晶等药物性状改变以及瓶身有漏气、裂纹等现象时,均不得使用。
6.严禁混合配伍,谨慎联合用药。本品应当单独使用,禁忌与其他药品混合配伍使用。
7.对老人、肝肾功能异常患者等特殊人群和初次使用中药注射剂的患者应当慎重使用,加强监测。
8.加强用药监护。用药过程中,应当密切观察用药反应,特别是开始30分钟。发现异常,立即停药,采用积极救治措施,救治患者。
二十五味珊瑚制剂药品说明书修订要求
一、【不良反应】项应当增加:
监测数据显示,该制剂可见以下不良反应报告:恶心、呕吐、腹泻、腹痛、腹部不适、胃肠胀气、反酸、皮疹、瘙痒、嗜睡、乏力、胸闷、心悸等。
二、【禁忌】项应当增加:
1.孕妇及哺乳期妇女禁用。
2.对本品及所含成份过敏者禁用。
三、【注意事项】项应当增加:
1.本品应当在医生指导下按规定量服用,不得任意增加服用量和服用时间。
2.儿童慎用。
3.严重肝肾功能不全慎用。
4.本品不宜与其他含乌头碱类的药物联合使用。
(注:如原批准说明书的安全性内容较本修订要求内容更全面或更严格的,应当保留原批准内容。说明书其他内容如与上述修订要求不一致的,应当一并进行修订。)
02、中药说明书修订不合格,不予注册销售
今年以来,国家药监局对多种药品的说明书进行修订,其中有不少药品是中成药,如壮骨止痛胶囊、金乌骨通胶囊等,具体如下表:
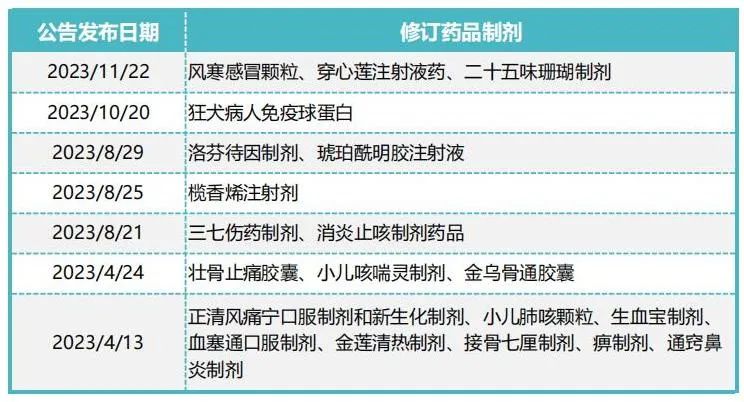
2023年2月,国家药监局发布《中药注册管理专门规定》,要求持有人应当加强对药品全生命周期的管理,加强对安全性风险的监测、评价和分析,应当参照相关技术指导原则及时对中药说明书【禁忌】【不良反应】【注意事项】进行完善。其中特别提到,中药说明书【禁忌】【不良反应】【注意事项】中任何一项在本规定施行之日满3年后申请药品再注册时仍为【尚不明确】的,依法不予再注册。
这意味着3年内,所有再注册的中药都必须包含药品不良反应、禁忌和注意事项等内容。
相关规定对企业来说可能短期会带来阵痛,那些禁忌症、不良反应等不明确的药今后就不能上市了。但是从长远来看,这有助于促进中成药行业良性、健康的发展。
此外,严格管控也来源于中成药对零售市场的巨大影响力,在OTC药品中近八成为中成药。对于药店来说,相关规定能够把中成药里说不清楚的东西全部剔除,这自然可以提高用药的安全性,让患者对更多药品形成信赖。
责任编辑:大花 WWW.1168.TV 2023-11-29 11:35:12
文章来源:搜药公众号
1.凡本网注明“来源:1168医药招商网”的所有作品,均为广州金孚互联网科技有限公司-1168医药招商网合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:1168医药招商网http://www.1168.tv”。违反上述声明者,本网将追究其相关法律责任。
2.本网转载并注明自其它来源(非1168医药招商网)的作品,目的在于传递更多信息,并不代表本网赞同其观点或和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。
3.其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
4.如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。联系邮箱:1753418380@qq.com。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。
 粤公网安备 44011102000390号
粤公网安备 44011102000390号