添加日期:2017年12月22日 阅读:1364
怕什么来什么,这边收到美国FDA发出警告信,那边省局就来了。
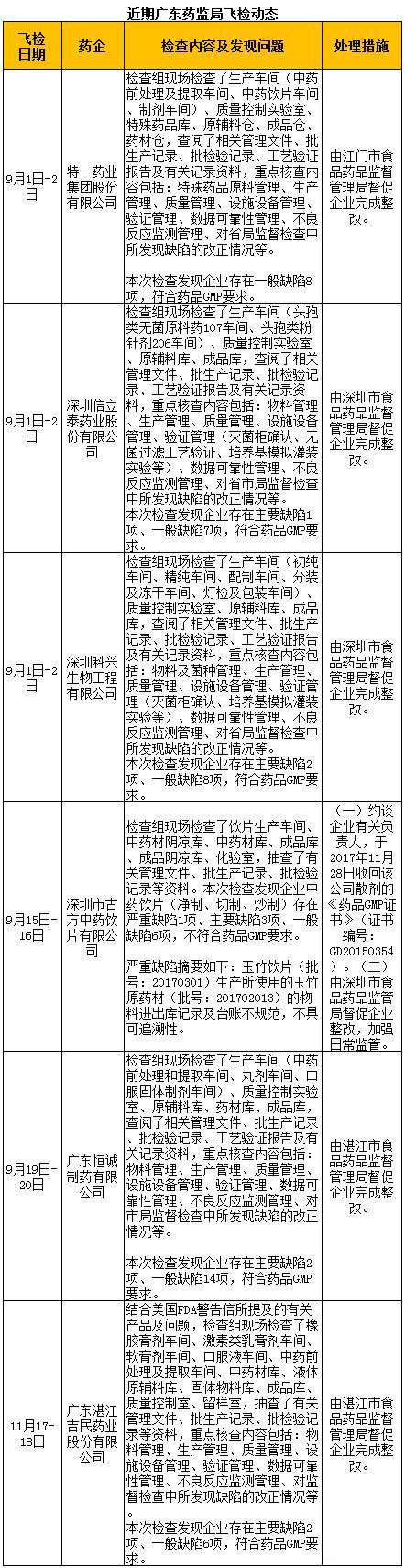
12月21日,广东省药监局官网发布了6则飞检通告,其中1则与美国FDA的警告信有关,另外5则是2017年度药品GMP飞行检查。
广东省药监局出动飞检
11月17日~18日,广东省药监局结合美国FDA警告信所提及的有关产品及问题,对广东湛江吉民药业股份有限公司进行飞检。
通告显示,检查组现场检查了橡胶膏剂车间、激素类乳膏剂车间、软膏剂车间、口服液车间、中药前处理及提取车间、中药材库、液体原辅料库、固体物料库、成品库、质量控制室、留样室,抽查了有关管理文件、批生产记录、批检验记录等资料。
重点核查内容包括:物料管理、生产管理、质量管理、设施设备管理、验证管理、数据可靠性管理、不良反应监测管理、对监督检查中所发现缺陷的改正情况等。
检查发现企业存在主要缺陷2项、一般缺陷6项,符合药品GMP要求。处理结果是由湛江市食品药品监督管理局督促企业完成整改。
多家中国药企收到FDA警告信
资料显示,10月30日,广东湛江吉民药业股份有限公司因为一系列问题收到FDA的警告信。
问题包括:1、用错原料生产药品,本应该用氢化可的松生产的药品实际用了地塞米松;2、检查员询问时解释说翻译错了;3、产品放行前未检验;4、未进行工艺验证,也没有进行持续工艺确认。
FDA在警告信中表示:“我们的调查人员检查记录时发现,公司的该产品在实际生产过程中使用的活性药物成分(API)为醋酸地塞美松,与标签中标明的氢化可的松完全不同。”
“当调查人员询问关于API混淆问题时,公司给出的解释是翻译错误,实际生产中使用的是同一种API。但公司质量部门却批准多批存在API混淆问题的产品运往美国。”
“2017年8月30日召回了该药品分销至美国的所有批次。然而,你们还没有提供有关贵公司质量部门职能失效的调查的详细信息,以及预防再次发生的行动计划。你们也没有提供有关确保所有你们放行至美国的药品都能使用适当的原料生产的评估。”
据不完全统计,2017年度FDA共对67家中国药企现场检查,**正式的通知有问题并采取**措施( 如警告信) 的有11家。
文章来源:医药观察家网
1.凡本网注明“来源:1168医药招商网”的所有作品,均为广州金孚互联网科技有限公司-1168医药招商网合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:1168医药招商网http://www.1168.tv”。违反上述声明者,本网将追究其相关法律责任。
2.本网转载并注明自其它来源(非1168医药招商网)的作品,目的在于传递更多信息,并不代表本网赞同其观点或和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。
3.其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
4.如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。联系邮箱:1753418380@qq.com。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。
 粤公网安备 44011102000390号
粤公网安备 44011102000390号