添加日期:2017年12月29日 阅读:1461
2017年,这一年巨量资本的注入和中国生物制药政策的逐步完善无一不加速着生物制药领域前进的步伐。据IMS Health预计,到2020年,我国生物医药市场将成为仅次于美国的全球第二大生物医药市场。
“数”说2017这不平凡的一年
“0”的突破:2017年6月2日,中国正式加入国际人用药品注册技术协调委员会(ICH);
“2”:2017年8月30日,美国FDA批准诺华的CTL019作为全球**CAR-T疗法正式上市;时隔不到50天,2017年10月19日,美国FDA批准Kite 的Yescarta作为全球第二款CAR-T疗法上市;
“2”:2017年上半年,美国FDA批准相继批准了两款PD-L1抗体的上市:辉瑞/默克的Avelumab和阿斯利康的Durvalumab;
450亿美元:据ChinaBio统计,中国生命科学领域VC/PE在过去30个月中已经筹集了450亿美元,投资了120亿美元;
300亿美元:据ChinaBio统计,中国生命科学领域基金于2016年募集资金200亿美元,而这一数字在2017年达到了300亿美元
…….
2017年,CAR-T细胞治疗领域,PD-1/PD-L1领域,生物类似物领域全线开花结果。与科研和临床相配套的便是资本的投入与政策的优化,有目共睹的是,这一年巨量资本的注入和中国生物制药政策的逐步完善无一不加速着生物制药领域前进的步伐。
2017年生物制药研发中的突破性技术
生物药物与传统化药在研发和生产中存在的很大的差异,生物药物通常指由多肽或者蛋白构成的细胞因子、单克隆抗体等,其合成场所为活体细胞,包括原核表达系统(大肠杆菌、乳酸菌、芽孢杆菌等),真核表达系统(酵母系统、昆虫系统)和哺乳动物细胞表达系统(CHO细胞、CHO-K1SV细胞、CHO-S细胞、HT-1080细胞、HEK293细胞等),这些菌体与细胞的生产环境与生产过程需要准确的分析与量化,因此工程菌与工程细胞的生长过程的精准分析技术对于优化生产工艺,提高目的产物的产率具有至关重要的作用。
在这一工艺领域,罗氏推出的Cedex Bio新一代生物过程分析系统,能够用于菌体或细胞的代谢物、底物浓度的准确分析,实时监测和优化整个发酵过程。Cedex Bio单机支持多参数培养系统,包括哺乳动物细胞、细菌和酵母,运用可靠的光度测量技术获得高检测灵敏度和广泛的动态范围,能够获得比酶膜法更准确稳定的数据。Cedex Bio自动稀释功能可以减少重复的取样和跟进测量操作,单台系统可覆盖多达二十三个检测参数,采用即插即用型试剂,无缝数据集成功能和直观的用户界面,让监测过程更友好高效。
以葡萄糖分析为例,和传统的膜技术相比,经Cedex Bio得到的数据具有更好的准确性、精密性、灵敏性和线性。在葡萄糖、乳酸、氨、乙酸、乙醇、谷氨酸、谷氨酰胺、钠、钾、LDH、IgG等参数分析中,和传统的电流法、光度法、HPLC法和离子选择性电极法相比,Cedex Bio系统具有检测准确快速及一体化的优势。因此Cedex Bio能够广泛适用于生物药物的研发、生产和质控等环节。
2017年生物制药生产能力实现“质变”
一次性生物反应器
传统的不锈钢系统的弊端相信大家都熟知,那就是灵活性极差,一个不锈钢系统一旦建成,那么在很大概率上就只能适用于一种生物制品的生产,这就给企业带来了巨大的成本负担。一次性使用系统之所以被迅速接受,除了能降低成本外,一次性系统还可以节约生物药制造过程中反复清洗、灭菌、消毒的过程,为制药企业节约了生产时间。
2017年5月16日,勃林格殷格翰宣布,使用一次性生物反应器的生物制药生产基地正式启用。作为国内首批开展生物制药合同生产(CMO)的试点企业之一,勃林格殷格翰将为全球客户提供从工艺开发到临床试验的全方位服务。
大型生物反应器
生物制品生产工艺的开发过程一般需要经历工程细胞库的构建、摇瓶工艺开发、小试工艺开发、中试放大、生产发酵、目的蛋白的纯化和制剂等步骤。在生产过程中,生物反应器的体积直接决定了每一批次得到的目的蛋白的质量,在我国由于大型生物反应器制造工艺的限制,万升级别的生物反应器极其罕见。这些生产中所面临的困难同样是制约我国生物制药产业发展的瓶颈。
可喜可贺的是,2017年12月6日,上海药明生物宣布其3万升生物制药生产基地正式全面投产。该基地是目前世界上*大的使用一次性反应器的生物制药GMP生产基地,同样是目前我国已投产的*大的生物药生产基地之一。在该生产基地中,药明生物已有134个项目在运行,其中35个项目已经进入一二期临床试验阶段,92个处在临床前阶段。这一基地的投产标志着我国在大型生物反应器上的制造能力及应用大型生物反应器的协同能力得到了显着提升。
模块化生物制药工厂
生物药物从研发到上市,耗时漫长,也牵制了大量的资金。究其原因,除了研发与临床阶段无法避免的高耗时外,符合GMP要求的工厂建设同样耗费了大量时间,那么如何缩短建设时间?GE医疗给出了解决方案,去年年初,喜康生物与GE医疗宣布**采用GE医疗模块化生物制药解决方案KUBioTM 的生物制药工厂在武汉正式落成。该方案将全球制药生产线建设领域比较标准的三年时间缩短为一年,显着加速了创新型生物药物的上市速度。时至今年,GE医疗KUBioTM模式复制到广东,在中新广州知识城建立了模块化生物制药工厂集群,为新药研发成果转化提供“一站式“公共服务平台。
2017年生物制药研究硕果累累
PD-1/PD-L1抗体喜讯不断
PD-1/PD-L1免疫疗法旨在利用人体自身的免疫系统抵御癌症,通过阻断PD-1/PD-L1信号通路使癌细胞死亡,具有治疗多种类型肿瘤的潜力,有望实质性改善患者生存。PD-1/PD-L1抗体自2014年经FDA批准以来,一直作为明星领域备受瞩目,截止现在五种已经上市的PD-1及PD-L1抗体已被批准用于11种肿瘤的治疗。目前已经上市的PD-1/PD-L1单抗药物有默沙东的Keytruda(pembrolizumab)、百时美施贵宝的Opdivo(nivolumab)、罗氏的Tecentriq(Atezolizumab)、默克的Bavencio(Avelumab)和阿斯利康的Imfinz(durvalumab)五款药物,而以上抗体均于2016到2017年内在中国开展了临床试验。除以上这些制药巨头外,国内制药企业在PD-1/PD-L1单抗方面的布局同样紧随其后,恒瑞医药、信达生物、百济神州的PD-1/PD-L1单抗已处于III期临床,君实生物的PD-1/PD-L1单抗已处于II期临床。
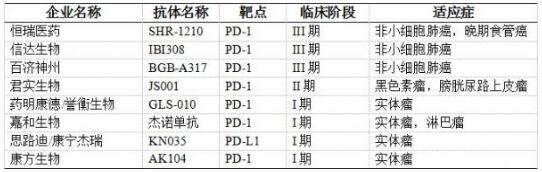
国内企业PD-1/PD-L1单抗的临床进展
尽管在今年6月以来,FDA考虑到PD-1/PD-L1单药疗法、联合泊马度胺或来那度胺或与其他药物的组合疗法治疗反复性或难治性多发性骨髓瘤(MM)患者的风险大于潜在受益,相继叫停了施贵宝Opdivo组合疗法、新基Imfinzi组合疗法治疗血液肿瘤的数项临床试验。但就在近日,FDA已解除了基于PD-1肿瘤免疫疗法Opdivo(nivolumab)的组合疗法治疗MM的2项临床研究CA209039和CA204142的部分暂停禁令,PD-1/PD-L1抗体在血液肿瘤的临床研究得以继续进行。
2017年11月2日,百时美施贵宝提交的PD-1单抗Opdivo的上市申请(JXSS1700015)获得CDE受理。Opdivo成为第*款在中国提交上市申请的PD-1/PD-L1单抗,预计将在2018年初获批上市。时隔不久,百时美施贵宝相继宣布:基于一项针对经治晚期或转移性非小细胞肺癌患者评估nivolumab对比多西他赛疗效的III期临床研究CheckMate-078的结果表明,在接受nivolumab治疗的患者中观察到显着的总生存(OS)获益;III期临床研究CheckMate-025结果表明在既往接受过治疗的晚期肾细胞癌患者中,Opdivo治疗组相比依维莫斯治疗组中患者的中位生存期和3年生存率显着提升。
目前,科学家们发现PD-1/PD-L1单抗的治疗作用不仅仅局限于肿瘤治疗方面,同样对具有起免疫缺陷症状的AIDS具有治疗作用。研究者们发现使用PD-1/PD-L1单抗治疗感染了HIV的肺癌患者时,患者体内HIV感染细胞储存库(the reservoirs of cells)呈现出了剧烈而持续的下降。
生物类似物研究紧追不舍
随着近期阿达木单抗(修美乐),依那西普(恩利),英夫利西单抗(类克)等一批重磅级原研生物药(其中“药王”阿达木单抗2014-2017年均销售额均为150亿美元左右)专利的陆续到期。生物类似物面临着巨大的市场机会。目前已经有近50种生物类似物在研发当中。
在2017上半年,FDA正式批准了韩国三星Bioepis的Renflexis (infliximab-abda)作为一款英夫利昔单抗的生物类似物上市。这是继FDA批准山德士**生物类似物(filgrastim-sndz)后批准的第五款生物类似物。山德士近日宣布,欧洲药品管理局(EMA)已受理该公司提交的pegfilgrastim(培非格司亭)生物仿制药上市许可申请(MAA)。
2017年12月2日,Mylan和Biocon公司宣布, FDA正式批准**赫赛汀生物类似物Ogivri(trastuzumab-dkst)上市,用以治疗包括过度表达HER2的乳腺癌和转移性胃癌。值得注意的是,这也是针对这两种特定癌症的第*款生物类似药。
而更多的生物类似物研发管线还在紧锣密鼓地推进中,相比于化学仿制药,生物类似物的上市价格与原研药相比降幅不大,这也为生物类似物研发生产企业提供了更大的利润空间。无论于患者还是于企业,生物类似物时代的到来所带来的利益都是巨大的。
结语:据IMS Health预计,到2020年,我国生物医药市场将成为仅次于美国的全球第二大生物医药市场。那么在这个过程中,中国生物制药产业会经历显着提升,我们要做的是,在研发创新和技术创新上找准风口,毕竟站在风口上,我们才能飞得更高。
文章来源:
1.凡本网注明“来源:1168医药招商网”的所有作品,均为广州金孚互联网科技有限公司-1168医药招商网合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:1168医药招商网http://www.1168.tv”。违反上述声明者,本网将追究其相关法律责任。
2.本网转载并注明自其它来源(非1168医药招商网)的作品,目的在于传递更多信息,并不代表本网赞同其观点或和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。
3.其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
4.如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。联系邮箱:1753418380@qq.com。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。
 粤公网安备 44011102000390号
粤公网安备 44011102000390号